K + H2O → KOH + H2 là phản xạ thế. Bài ghi chép này cung ứng rất đầy đủ vấn đề về phương trình chất hóa học và được cân đối, ĐK những hóa học nhập cuộc phản xạ, hiện tượng lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng K + H2O → KOH + H2
Bạn đang xem: K + H2O → KOH + H2 | K ra KOH
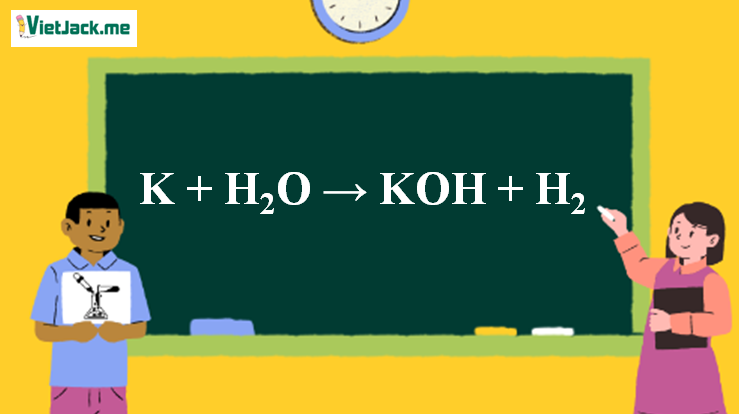
1. Phương trình chất hóa học K đi ra KOH
2K + 2H2O → 2KOH + H2
2. Điều khiếu nại phản xạ thân ái sắt kẽm kim loại K với H2O
Nhiệt chừng thường
3. Cách triển khai phản xạ K với H2O
Cho mẩu nhỏ kali vô ly nước.
4. Hiện tượng phân biệt phản xạ sắt kẽm kim loại K với H2O
Kali (K) white color bạc phản xạ mạnh với nước và xuất hiện tại bọt Lúc vì thế Hidro (H2) được hóa giải, sau phản xạ nhận được hỗn hợp kiềm, thực hiện quỳ tím gửi quý phái greed color.
5. Tính Hóa chất của Kali
K với tính khử cực mạnh.
5.1. Tác dụng với phi kim
Ví dụ:
4K + O2 → 2K2O
2K + Cl2 → 2KCl
Khi nhen vô bầu không khí hoặc vô oxi, kali cháy tạo nên trở thành những oxit (oxit thông thường, peoxit và supeoxit) và mang lại ngọn lửa có màu sắc tím hoa cà đặc thù.
5.2. Tác dụng với axit
Kali đơn giản dễ dàng khử ion H+ (hay H3O+) vô hỗn hợp axit loãng (HCl, H2SO4 loãng...) trở thành hidro tự tại.
Ví dụ: 2K + 2HCl → 2KCl + H2.
5.3. Tác dụng với nước
K tính năng mạnh mẽ với nước và tự động rực rỡ tỏa nắng tạo nên trở thành hỗn hợp kiềm và hóa giải khí hidro.
2K + 2H2O → 2KOH + H2.
5.4. Tác dụng với hidro
Kali tính năng với hidro ở áp suất tương đối rộng và sức nóng chừng khoảng chừng 350 – 400oC tạo nên trở thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
6. Tính Hóa chất của H2O
6.1. Nước tính năng với kim loại
Ở ĐK thông thường, nước hoàn toàn có thể phản xạ với những sắt kẽm kim loại mạnh như Li, Ca, Na, K, Ba,… muốn tạo trở thành hỗn hợp Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một vài sắt kẽm kim loại khoảng như Mg, Zn, Al, Fe,…phản ứng được với tương đối nước ở sức nóng chừng cao dẫn đến oxit sắt kẽm kim loại và hidro. Dường như, sắt kẽm kim loại Mg tan cực kỳ lờ đờ nội địa rét.
6.2. Nước tính năng với oxit bazo
Nước tính năng với một vài oxit bazo như Na2O, CaO , K2O,… tạo nên trở thành hỗn hợp bazo ứng. Dung dịch bazo thực hiện mang lại quỳ tím hóa xanh rờn.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
6.3. Nước tính năng với oxit axit
Nước tính năng với oxit axit tạo nên trở thành axit ứng. Dung dịch axit thực hiện quỳ tím hóa đỏ ửng.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
7. Vai trò của H2O
- Nước cực kỳ quan trọng mang lại cuộc sống hằng ngày, phát hành nông nghiệp, công nghiệp, xây cất, giao thông vận tải vận tải đường bộ... Sự sinh sống bên trên Trái Đất đều bắt mối cung cấp kể từ nước và tùy theo nước. Nước với tác động ra quyết định cho tới nhiệt độ một điểm và là vẹn toàn tự tạo đi ra khí hậu.
- Nước là bộ phận cần thiết của những tế bào sinh học tập và là môi trường xung quanh của những quy trình sinh hóa cơ phiên bản như quang đãng thích hợp tạo nên trở thành khí oxi:
6H2O + 6CO2 →(quang hợp) C6H12O6 + 6O2
- Nước nhập cuộc và nhiều quy trình hoá học tập cần thiết vô khung hình người và động vật hoang dã. Nước cướp rộng lớn 70% khung hình tất cả chúng ta.
8. Bài luyện vận dụng
Câu 1. Nhỏ kể từ từ từng giọt cho tới không còn 30 ml hỗn hợp HCl 1M vô 100 ml hỗn hợp chứa chấp K2CO3 0,2M và KHCO3 0,2M. Sau Lúc phản xạ kết thúc đẩy, thể tích khí CO2 nhận được là
A. 224 ml.
B. 336 ml.
C. 672 ml.
D. 448 ml.
Lời giải:
Đáp án: A
Giải thích:
nHCl= 0,03 (mol)
nK2CO3 = 0,1.0,2 = 0,02 (mol);
nKHCO3 = 0,1.0,2 = 0,02 (mol)
Khi nhỏ kể từ từ H+ vào dd láo lếu thích hợp CO32- và HCO3- xẩy ra phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
Xem thêm: Màu xanh dương là gì? Ý nghĩa màu xanh dương trong cuộc sống
=> nCO2(2) = ∑nH+ - nCO32- = 0,03 – 0,02 = 0,01 (mol)
=> VCO2 (đktc) = 0,01.22,4 = 0,224 (l) = 224 (ml)
Câu 2. Dãy bao gồm những sắt kẽm kim loại đều phản xạ với nước ở sức nóng chừng thông thường dẫn đến hỗn hợp với môi trường xung quanh kiềm là
A. Na, Ba, K
B. Be, Na, Ca
C. Na, Fe, K
D. Na, Cr, K
Lời giải:
Đáp án: A
Giải thích:
2A + 2H2O → 2AOH + H2 (A là sắt kẽm kim loại kiềm)
B + 2H2O → B(OH)2 + H2(B là sắt kẽm kim loại kiềm thổ, trừ Be)
2Na + 2H2O → 2NaOH + H2
Ba + 2H2O → Ba(OH)2 + H2
2K + 2H2O → 2KOH + H2
Câu 3. Nhận tấp tểnh nào là tại đây ko trúng về sắt kẽm kim loại kiềm?
A. Đều với cấu trúc mạng tinh nghịch thể tương tự nhau: lập phương tâm khối
B. Là những nhân tố nhưng mà vẹn toàn tử có một e ở phân lớp p
C. Dễ bị oxi hóa
D. Năng lượng ion hóa loại nhất của những vẹn toàn tử sắt kẽm kim loại kiềm thấp rộng lớn đối với những nhân tố không giống vô nằm trong chu kì
Lời giải:
Đáp án: B
Câu 4. Nhận tấp tểnh nào là sau đó là đúng:
A. Bari là nhân tố với tính khử vượt trội nhất vô sản phẩm sắt kẽm kim loại kiềm thổ
B. Tất cả những sắt kẽm kim loại kiềm thổ đều tan nội địa ở sức nóng chừng thường
C.Kim loại kiềm thổ với tính khử mạnh rộng lớn sắt kẽm kim loại kiềm
D. Tính khử của những sắt kẽm kim loại kiềm thổ tăng dần dần kể từ Be cho tới Ba.
Lời giải:
Đáp án: D
Giải thích:
Mg và Be ko phản xạ với nước ở ĐK thông thường B sai.
Đi từ trên đầu group IIA cho tới cuối group theo hướng tăng dần dần năng lượng điện tính phân tử nhân tính sắt kẽm kim loại (tính khử) tăng dần dần => Kim loại vượt trội nhất là Ra; yếu ớt nhất là Be. => A sai, D trúng.
Nhóm Kim loại kiềm với tính khử vượt trội nhất => C sai.
Câu 5. Cặp hóa học nào là tiếp sau đây với phản ứng
A. H2SO4 và KHCO3.
B. MgCO3 và HCl.
C. Ba(OH)2 và K2CO3.
D. NaCl và K2CO3.
Lời giải:
Đáp án: D
Câu 6. Khi mang lại quỳ tím vô hỗn hợp axit, quỳ tím thay đổi màu gì:
A. Đỏ
B. Xanh
C. Tím
D. Không màu
Lời giải:
Đáp án: A
Câu 7. Cho mẩu K vô nước thấy với 4,48 lít (đktc) khí cất cánh lên. Tính lượng K
A. 9,2 g
B. 15,6 g
C. 7,8 g
D. 9,6 g
Lời giải:
Đáp án: B
Giải thích:
nH2 = 4,48/22,4 = 0,2 mol
2K + 2H2O → 2KOH + H2
0,4 ← 0,2 mol
mK = 0,4.39 = 15,6 gam
Câu 8. Cho quỳ tím vô nước vôi vô, hiện tượng lạ xẩy ra là
A. Quỳ tím thay đổi màu đỏ
B. Quỳ tím ko thay đổi màu
C. Quỳ tím thay đổi màu xanh
D. Không với hiện tại tượng
Lời giải:
Đáp án: C
Xem tăng những phương trình phản xạ chất hóa học khác:
BaCl2 + NaHSO4 → BaSO4 + Na2SO4 + HCl
Ba + H2O → Ba(OH)2 + H2
Xem thêm: Chuyển đổi Euro (EUR) và Việt Nam Đồng (VND) Máy tính chuyển đổi tỉ giá ngoại tệ
BaO + H2O → Ba(OH)2
Ba(HCO3)2 + NaOH → BaCO3 + Na2CO3 + H2O
C + H2SO4 → SO2 + CO2 + H2O